"إذا أردنا زيادة قيمة الألماس المادية يجب علينا أن نجعله نادرا وقليل وصعب الحصول عليه الا بمشقة وهذا عبر تخفيض الانتاج."
ـ أرنست اوبنهايمر؛ زعيم تجارة الاحتكار الألماسي.
أصل تسمية الألماس:
كلمة dimond مشتقة من الكلمة اليونانية القديمة "adamas" وتعني الصلابة و"محال التطويع".
لكن صعب التنبؤ أو معرفة متى بالضبط صارت كلمة adamas " محال التطويع" مقصودة بالألماس فقط، لأن معادن كثيرة غير الألماس صلبة وربما كان المعنى عنصر الكودنوم أو الياقوت وغيره...
أما أصل كلمة الألماس باللغة العربية ما جاءت من صفة بل جاءت اقتباسا وتحريفا من الكلمة اليونانية في العصر العباسي عندما قامت أكبر حركة ترجمة عرفتها الإنسانية، بينما كان يُعرف قبل لك بالدُّر وكانوا يطلقون كلمة الدُّر على كثير من الأحجار الكريمة لتشابه ألوانها وصفاتها. جاء في لسان العرب لابن المنظور أن قبائل العرب البدو الرحل البدائية في افريقيا والشرق الأوسط قد استعملو كلمة ادماس (ألماس) الى أذماس. فقال:" إنها معرب أذماس اليونانية وقد حرفوها عند التعريب بقلب الذال الى لام لتقارب صورتها ومخارجها وتناغمها عند اللفظ والكلام".
تكوين الألماس وتركيبته:
الألماس يتكون من عنصر الكربون وحده، فقط تحت ضغط عالي ودرجة حرارة مرتفعة في ظروف غير معلومة بباطن الأرض. والألماس أحد متآصلات الكربون البلورية ومعنى كلمة متآصل هو أن يكون للعنصر اختلاف في الخواص الفيزيائية مع التشابه في الخواص الكيميائية. وبكل تأكيد أن الكربون أحد العناصر المتميزة في ظاهرة التآصل لأنه هو نفسه المكون للألماس والفحم والجرافيت الموجود بأقلام الرصاص.
ألا يبدو غريباً كيف يكون العنصر المكون للألماس -أقسى المعادن المعروفة- هو نفسه ذات العنصر الموجود بأقلام الرصاص التي بأيدينا؟! الكيمياء فعلا لعبة...
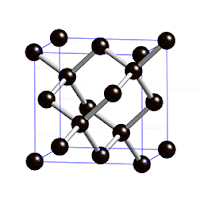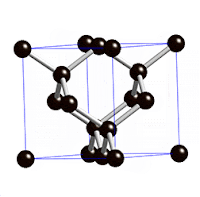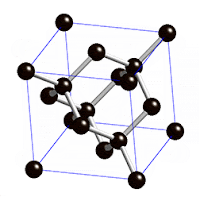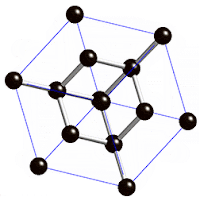
لكن السبب العلمي يعود لتشكيل الذرات في الفراغ ففي الألماس تتشكل ذرات الكربون تكعيبيا ويتخذ أشكال مضاعفة لذلك البناء التكعيبي ذو ثمانية الأوجه
فتتكون شبكة كرستالية شفافة أما في الجرافيت فتكوّن شبكة أيضا، لكن قاتمة. ولنفهم السبب في اختلاف الألوان بين الألماس والجرافيت أو حتى لون قميصك، يجب أن نفهم طريقة تناقل الإلكترون في الذرة من متسوى لآخر وهذا عن طريق امتصاص طاقة؛ ففي شكل الألماس كل كربونة داخل الشبكة متمسكة بالأخريات بقوة فما هي ماخذه راحتها عشان تمتص طاقة، فالإلكترونات جالسة في مكانها، وعشان كذا يكون الألماس غالبا clourless عديم اللون.
أما بعض الألماسات الملونة وغالبا تكون صناعية فهي تتأثر بعدة عوامل تحدد لونها وشدّته، ومنها:
*الفراغات الكيميائية والعيوب في الشبكة الكرستالية هي المسؤولة عن هذا التوزيع اللوني في الألماسة الواحدة.
*الوضوح في الألماس، وهو الجودة النوعية المرتبطة بالانحرافات الداخلية خلال رحلة التكوين، وتسمى بـ "التضامين".
وهذه التضامين لا تؤثر على أداء الألماس وصلابته او السلامة الهيكيلة، ولكن ستوجِد غيوم داخلية كبيرة الحجم تؤثر في اسياب وانتشار الضوء داخل الحجر؛ وبالتالي انعكاسه على الخارج.
خصائص الألماس:
صفات الألماس الفيزيائية كثيرة لكن أشهرها وأميزها أنه أشد المعادن صلابة وقسوة فهو الوحيد من بين المعادن له درجة الصلابة ١٠/١٠ ولهذا يستخدمونه في الصناعة كشفرة لنحت الجبال أو الصخور، وأيضا يستخدمونه على رأس أنابيب حفر الآبار العميقة ،والحُلي طبعًا.
وللنظام البلوري بصورة عامة خاصية تشتتيت الضوء ولكن في الألماس تعتبر عالية جدا لنفس السبب.
والألماس يعتبر الحجر الوحيد بين الأحجار الكريمة جميعها، المتكون من (عنصر واحد) فقط، فلو قمنا بتعريفه هو جسد كربوني صلب جدا مقيد وموثوق برباط الوصل الذري الذي يشد الجزئيات إلى بعضها البعض بقوة وبتنظيم متكرر، ولهذا عادة ما تكون الأسطح الخارجية للألماس ملساء.
رحلة نضوج الألماس الطبيعي:
تتم عملية التحوّل من الشكل الكربوني إلى الألماس داخل الحمم البركانية الذائبة في باطن الأرض وتندفع مع قذيفة البراكين صخور حاملة بداخلها الألماس الطبيعي وتكون بالطبع صخور منسلخة تحت وطأة الضغط الباطني للأرض.
وبعد استخراجه من مصادره الطبيعة يكون متسخًا وملتصقٌ به الكثير من الصخور والرمال التي رافقته خلال رحلة الصعود إلى سطح الأرض. وهناك طريقة مستهلكة في استخلاص الألماس من هذه الشوائب وأول مرحلة هي يجب أن تطحن تلك الصخور جيدا بواسطة مطاحن خاصة، ثم تمزج الصخور المطحونة بالماء وبعض المواد الكيميائية لتصبح كالعجينة لتسهيل العملية، ثم تمر العجينة بمراحل آخرها الطرد المركزي. بعد كذا تكون كل الصخور المسامية قد استُخلِصَت، وتبقى آخر خطوة للتأكد من عدم إضاعة أي فتة ألماسة فتمرر العجينة على طاولة من الشحوم، لأن الألماس يعلق بالشحوم ويتماسك حولها، وبعدها تُسخن الشحوم لدرجة الغليان وتتبخر ويبقى الألماس العالق بها. وبتمرير العجينة عدة مرات على طاولة الشحوم فإن ٩٥٪ من الألماس يكون قد استخرج من الصخور.
Remember; pressure
makes diamond :)
ألقاكم في مواضيع قادمة..
إلى اللقاء ❤️
المراجع:
كتاب قصة حجر الألماس الأسطورة والحقيقة؛ للمستشار محمد أبو غوش